 Sala de espera de las consultas de un hospital madrileño.SAMUEL SÁNCHEZ
Sala de espera de las consultas de un hospital madrileño.SAMUEL SÁNCHEZ
Las diferencias entre sus sistemas inmunitarios ayudan a entender que el riesgo de trastornos como autismo y alzhéimer varíe entre sexos
Supongamos que una pareja tiene dos hijos, un niño y una niña. Lo más probable es que ambos crezcan con cerebros normales y sanos. Pero si el desarrollo del cerebro de alguno de ellos sufre alguna alteración o experimenta problemas de salud mental, es posible que el camino de ambos hermanos sea diferente. Las diferencias del hijo varón podrían aparecer primero.
En igualdad de condiciones, él tiene cuatro veces más probabilidades que su hermana de ser diagnosticado con autismo. Las tasas de otros trastornos y discapacidades del neurodesarrollo también son más altas en los niños. A medida que crezca y se convierta en un hombre joven, sus posibilidades de desarrollar esquizofrenia serán dos o tres veces mayores que las de su hermana. Cuando ambos lleguen a la pubertad, esos riesgos relativos cambiarán. La hermana tendrá casi el doble de probabilidad de sufrir depresión o un trastorno de ansiedad. Mucho más adelante en la vida, tendrá un mayor riesgo de desarrollar alzhéimer.
Esas tendencias no son reglas estrictas, por supuesto: los hombres pueden sufrir depresión y alzhéimer; algunas niñas desarrollan autismo; y las mujeres no son inmunes a la esquizofrenia. Los cerebros masculinos y femeninos son más parecidos que diferentes.
Para explicar estas diferencias entre los sexos hay algunos lugares obvios donde buscar respuestas. Los dos cromosomas X femeninos y la copia única masculina es uno de esos lugares. Las diferentes hormonas sexuales —en particular, la testosterona en los varones y el estrógeno en las mujeres— es otro. Pero un campo de investigación en constante crecimiento apunta a una influencia menos obvia: las células y moléculas del sistema inmunitario.
Durante mucho tiempo, los científicos han tenido evidencia que vincula la actividad inmunitaria con las diferencias y los trastornos cerebrales, pero la ciencia que incorpora el sexo a esa ecuación aún está en desarrollo. Hasta la última década, los neurocientíficos solían utilizar solo animales machos en sus experimentos por temor a que los ciclos hormonales femeninos interfirieran con los resultados. Al final, eso resultó ser un problema mucho menor de lo que se pensaba originalmente. Además, los científicos ahora saben que las hormonas en los roedores machos también pueden fluctuar casi igual —no en un ciclo fijo, sino en respuesta a factores como su posición en la jerarquía social del grupo de su jaula—. Desde 2016, los Institutos Nacionales de Salud de Estados Unidos han pedido a quienes solicitan fondos para investigación que usen animales de ambos sexos o que expliquen por qué solo usan uno.
En estudios recientes, los neurocientíficos han descubierto que las células inmunitarias llamadas microglías funcionan de manera diferente en los cerebros en desarrollo de roedores machos y hembras, aun en ausencia de cualquier infección. Estas acciones microgliales, reflejadas en estudios en humanos, pueden predisponer a los niños a la aparición temprana de diferencias y trastornos neuronales, según especulan los investigadores, pero podrían protegerlos a medida que crecen. Los científicos también han identificado varios genes implicados en las respuestas inmunitarias que podrían ayudar a explicar los riesgos aumentados para las niñas y las mujeres a partir de la pubertad. Con el tiempo, una mejor comprensión de estas diferencias podría llevar a tratamientos específicos para cada sexo.
“Estamos empezando a profundizar en esto”, dice Justin Bollinger, neurocientífico de la Universidad de Cincinnati. “Es muy importante y muy triste que, durante mucho tiempo, los investigadores sintieran que los hombres eran suficientes, que los hombres y las mujeres actuaban de la misma manera, que respondían a las mismas cosas”.
Inmunidad en el cerebro en desarrollo
Una de las primeras pistas que vinculan el desarrollo del cerebro y las respuestas inmunitarias surgió a fines de los años ochenta, cuando los investigadores examinaron los registros de nacimiento y los registros de hospitales psiquiátricos en Finlandia, donde hubo una epidemia de gripe en el otoño de 1957. Los científicos descubrieron que, si las mujeres embarazadas habían cursado el segundo trimestre de gestación durante ese otoño, sus hijos adultos tenían un 50 % más de probabilidades de ser admitidos en el hospital con un diagnóstico de esquizofrenia que los hijos de mujeres que habían pasado su primer o tercer trimestre durante la epidemia.
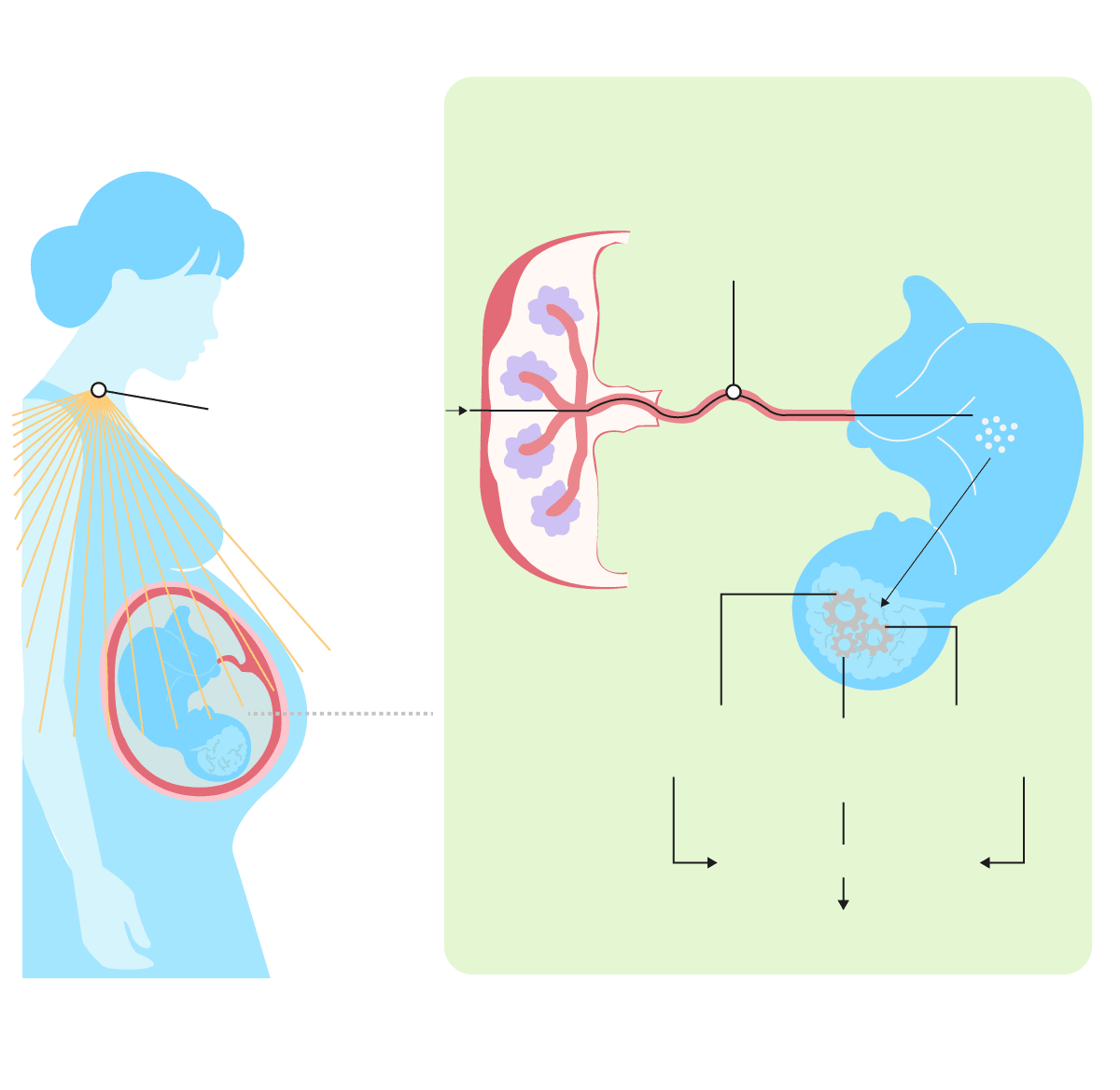
Cómo influye una infección materna en el cerebro del bebé
Madre
Placenta
Feto
Moléculas pro-inflamatorias
pasan al feto en desarrollo
a través de la placenta
Una infección
activa el sistema
inmunitario de
la madre
Activación de
las microglías
Disfunción
mitocondrial
Estrés
oxidativo
Neuroinflamación
Otros estudios respaldaron este hallazgo, lo que sugiere que si el sistema inmunitario de una mujer debe combatir una infección durante el embarazo puede predisponer a su descendencia a la esquizofrenia. “Eso realmente ha llamado mucho la atención sobre cómo el sistema inmunitario puede hacer que el cerebro en desarrollo se altere”, dice Margaret McCarthy, neurocientífica de la Facultad de Medicina de la Universidad de Maryland, en Baltimore. En tanto, investigadores en Nueva York documentaron una variedad de desafíos neurológicos en los hijos de madres que contrajeron rubeola durante un brote de 1964, incluida una tasa inusualmente alta de autismo.
Para imitar los efectos de los brotes en las poblaciones humanas e investigar los posibles mecanismos, los científicos han inyectado fragmentos no infecciosos de bacterias o virus en ratas y ratonas preñadas. Esto provoca una respuesta inmunitaria en la madre, que a su vez influye en la actividad inmunitaria de su descendencia. Luego, los investigadores estudian a las crías después de que nacen.
Estos estudios han respaldado la idea de que la infección materna afecta el cerebro del bebé. Si bien es difícil decir si un roedor está experimentando signos específicos de autismo o esquizofrenia, los científicos observan que las crías son más ansiosas y menos sociables que las nacidas de madres que no tuvieron que hacer frente a un desafío inmunitario.
Las crías también tienen más microglías, y más activas. Estas células, que constituyen el 10% del cerebro, son las células inmunitarias residentes en el órgano: su trabajo es absorber bacterias, virus y hongos invasores, así como consumir los desechos celulares habituales. Pero hacen mucho más que eso. Las microglías también liberan sustancias químicas conocidas como factores de crecimiento, que colaboran con el cerebro. Y durante el desarrollo fetal rompen las conexiones innecesarias entre las células nerviosas, o incluso eliminan las células por completo —acciones que dan forma al cableado cerebral—. Si las microglías son expuestas a una infección durante este momento crítico, algunos científicos sugieren que el cableado podría salir mal y el cerebro sufriría consecuencias a largo plazo.
Hasta ahora, la evidencia de estos efectos es más limitada en humanos, pero los estudios de escaneo cerebral y las autopsias encuentran cantidades inusualmente altas de microglías activas en personas con esquizofrenia o autismo.
Microglías masculinas y femeninas
El sexo agrega otra variable al vínculo entre las microglías y el desarrollo del cerebro: estas células se comportan de manera diferente en ciertas partes del cerebro masculino y femenino en desarrollo, aun cuando todo transcurra normalmente.
Tomemos, por ejemplo, los hallazgos de McCarthy de 2019 hechos en ratas jóvenes mientras jugaban. El juego en los animales jóvenes está influenciado por una región del cerebro llamada amígdala, y se sabe que el efecto de la testosterona en la amígdala predispone a los machos a jugar bruscamente —esta tendencia no se observa en las hembras—. Los investigadores encontraron que las microglías en la amígdala eran más activas en los machos, debido a la exposición a la testosterona en el útero. Las microglías masculinas altamente activas se comían otro tipo de células en forma de estrella llamadas astrocitos. “Básicamente, se dedican a asesinar células”, dice McCarthy.
En ratas hembra, los científicos observaron que esos astrocitos sobreviven y parecen amortiguar la activación de las células nerviosas de la amígdala, y esta amortiguación, a su vez, parece reducir la violencia. Y cuando los investigadores usaron un anticuerpo para evitar que las microglías mataran a los astrocitos relevantes en las crías macho, los animales dejaron de jugar bruscamente. McCarthy dice que los astrocitos, cuando están presentes, suprimen la actividad de los nervios en tiempo real para evitar el juego brusco.
Hay muchas otras formas reportadas en las que las microglías actúan de forma diferente en los cerebros de roedores machos y hembras a una edad muy temprana. Y esas diferencias pueden tener consecuencias a largo plazo, en particular si la madre padece una infección o si los científicos provocan una en el laboratorio. Por ejemplo, los autores de un estudio de 2020 observaron las microglías en la descendencia adulta de ratonas expuestas a una molécula sintética que imita el material genético de un virus. Se centraron en una parte del cerebro llamada giro dentado, una región involucrada en el aprendizaje y la memoria que suele ser más pequeña en las personas con esquizofrenia.
En el estudio, los ratones macho nacidos de madres tratadas con el imitador viral tuvieron una mayor densidad de sinapsis —conexiones entre las células nerviosas— que la que hay habitualmente en el giro dentado. Esto fue así tanto para las sinapsis excitatorias, en las que una neurona excita la actividad de la siguiente, como para las sinapsis inhibitorias, en las que una neurona amortigua la actividad de otra. En las mujeres, al contrario, el tratamiento de la imitación viral resultó en menos sinapsis excitatorias y pocos cambios en las inhibidoras. Estos cambios en las proporciones de las sinapsis de “encender” y “apagar” tienen similitudes con los desequilibrios de sinapsis observados en la esquizofrenia humana y, además, sugieren que el patrón difiere entre hombres y mujeres.
Con base en esta y otras investigaciones, la hipótesis de trabajo es que la activación inmunitaria en el cerebro, muy temprano en la vida, cambia las microglías y, de alguna manera, “prepara” al cerebro para las diferencias que surgen más adelante. No está claro exactamente cómo podría funcionar esto, dice Jaclyn Schwarz, neurocientífica de la Universidad de Delaware en Newark, Estados Unidos. Una posibilidad es que las microglías de los machos, distraídas por combatir una infección, se salten parte del trabajo de poda neuronal que normalmente realizan durante el desarrollo fetal. Alternativamente, especula Schwarz, tal vez las microglías masculinas se vuelvan hiperactivas a largo plazo, podando demasiadas conexiones neuronales a medida que el cerebro continúa desarrollándose durante la infancia, la adolescencia y la edad adulta.
El cerebro femenino
En los adolescentes humanos, el patrón general de diferencias entre los sexos en las enfermedades mentales se invierte. Las mujeres y las niñas adolescentes son más susceptibles a los trastornos del estado de ánimo como la depresión y la ansiedad, que tienen menos que ver con el cableado del cerebro durante el desarrollo y más con los procesos químicos en curso dentro del cerebro, dice Schwarz.
El cerebro no es el único lugar donde el sistema inmunitario difiere según el sexo: ante las infecciones, las mujeres suelen generar una respuesta inmunitaria más fuerte que los hombres. Cuando los neurocientíficos estudiaban solo roedores machos, los inmunólogos, por el contrario, a menudo se centraban en las hembras y sus células porque ofrecen una respuesta más sólida, dice Natalie Tronson, neurocientífica del comportamiento de la Universidad de Michigan en Ann Arbor. Las mujeres pagan un precio por esa poderosa respuesta con una mayor tasa de enfermedades autoinmunes, como el lupus.
Los investigadores han analizado los genes que se activan y desactivan en el tejido cerebral de personas que sufrían depresión y descubrieron que los patrones de uso de los genes difieren según el sexo. “Lo que sucede en el cerebro de un hombre o una mujer con depresión es muy diferente”, dice Georgia Hodes, neurocientífica del Virginia Tech, en la Universidad Estatal de Virginia, en Blacksburg, y coautora de esa investigación. Un patrón que han visto en las mujeres son los cambios en la actividad de los genes involucrados en la inflamación, un mecanismo inmunitario clave.
La inflamación cerebral también está estrechamente relacionada con la enfermedad de Alzheimer, y el sexo también influye en el riesgo: los primeros síntomas generalmente surgen a los 60 años, y las mujeres tienen más probabilidades que los hombres de ser diagnosticadas. En un estudio de 2021, Marina Sirota, bioinformática de la Universidad de California en San Francisco, y sus colegas examinaron qué genes se activaban o desactivaban en los cerebros de las personas con alzhéimer que habían fallecido. En el trabajo descubrieron alteraciones en la actividad de los genes que podrían influir en la actividad inmunitaria en mujeres que tenían alzhéimer en comparación con las que no lo tenían. No vieron esa diferencia en los hombres.
Sirota dice que hay más trabajo por hacer para entender por qué estos patrones genéticos cambian en las mujeres y cómo podrían influir en el curso de la demencia. (De hecho, su especialidad es integrar datos complejos de inmunidad; recientemente escribió una revisión sobre el tema para el Annual Review of Biomedical Data Science). En cuanto a los hombres mayores, las microglías que pueden aumentar el riesgo durante el desarrollo podrían ser beneficiosas en la vejez. Otro estudio del tejido cerebral de personas con alzhéimer encontró que las microglías de los cerebros de los hombres tenían más probabilidades de adoptar una forma similar a la de una ameba, asociada con la actividad protectora, que las microglías de las mujeres.
Los estudios en ratones indican que hay diferencias incluso entre los cerebros masculinos y femeninos sanos a medida que los animales envejecen. Investigadores liderados por Bill Freeman, neurocientífico de la Fundación de Investigación Médica de Oklahoma en Oklahoma City, examinaron los patrones de actividad genética y proteínas en los cerebros de ratones de dos años (una edad madura para un ratón). Así, vieron que mientras la inflamación aumentaba con la edad en los cerebros de ambos sexos, el cambio era más prominente en las hembras.
Por lo tanto, mientras que los estudios en varones apuntan a las microglías como un actor relevante tanto en el riesgo temprano como en la protección posterior, la situación en las mujeres parece involucrar una serie de genes inmunitarios que pueden influir en el riesgo de inflamación, trastornos del estado de ánimo y demencia, de una manera que aún no se comprende totalmente.
Un paso hacia la equidad en salud
Los científicos por ahora solo pueden especular sobre por qué evolucionaron estas diferencias, pero muchos apuntan al simple hecho de que las hembras pueden quedar embarazadas. El sistema inmunitario de la madre no debe atacar al feto, aun cuando sea genéticamente diferente al de su propio cuerpo. Por lo tanto, el embarazo provoca una serie de cambios en la inmunidad, algunos de los cuales amortiguan el sistema de defensa de la madre, haciéndola más propensa a enfermedades graves causadas por algunas infecciones, como la covid 19 y la varicela.
“Los hombres no parecen tener esa flexibilidad en su sistema inmunitario”, dice Hodes. “Siempre tienen las mismas respuestas inmunitarias a lo largo de su vida, con algunos cambios al envejecer”. Pero la flexibilidad inmunitaria femenina —necesaria para proteger al feto— puede tener un costo para el cerebro de la mujer.
Todavía nadie está diseñando píldoras rosadas y azules. Pero catalogar esas diferencias es un primer paso importante para comprender cómo interactúan el sexo, el cerebro y el sistema inmunitario en la salud y en la enfermedad. Llegar a la raíz de esas diferencias y, en última instancia, desarrollar diferentes tratamientos para distintas personas es crucial para lograr la equidad en salud.
“Estamos tratando de entender la biología, estamos tratando de mejorar la salud”, dice Freeman. “Eso significa comprender la diversidad de nuestra especie humana”.
Fuente;https://elpais.com/salud-y-bienestar/2023-01-25/los-secretos-del-cerebro-que-ayudan-a-explicar-por-que-algunas-enfermedades-afectan-mas-a-hombres-y-otras-a-mujeres.html

Sé el primero en comentar en «Los secretos del cerebro que ayudan a explicar por qué algunas enfermedades afectan más a hombres y otras a mujeres»